
新發(fā)突發(fā)傳染病已成為全球公共衛(wèi)生的巨大挑戰(zhàn),疫苗接種是傳染病防控最為經(jīng)濟(jì)有效的科學(xué)手段之一。艾滋病毒、新型冠狀病毒、結(jié)核分枝桿菌等多種高致病性微生物主要通過生殖道、呼吸道等黏膜表面入侵宿主。因此,在黏膜表面誘發(fā)出高效、持久的特異性免疫應(yīng)答對(duì)于研發(fā)下一代高效黏膜疫苗至關(guān)重要。
近些年,病毒載體疫苗取得了快速發(fā)展。例如,基于腺病毒載體(Ad)的新冠疫苗等已在多個(gè)國(guó)家獲批臨床應(yīng)用。目前,Ad載體疫苗主要以肌肉注射方式使用,可有效激發(fā)系統(tǒng)性免疫應(yīng)答,但其黏膜免疫應(yīng)答較弱。相較而言,黏膜免疫(例如鼻噴)可在呼吸道、生殖道等黏膜表面產(chǎn)生高水平的免疫應(yīng)答,進(jìn)而起到更好地保護(hù)效果。然而,如何突破黏膜黏液的物理屏障、強(qiáng)降解能力、附著性差等是研發(fā)高效黏膜疫苗所面臨的重大科學(xué)挑戰(zhàn)。
針對(duì)該難題,我校公共衛(wèi)生學(xué)院(深圳)孫彩軍教授聯(lián)合浙江大學(xué)及中科院等團(tuán)隊(duì)通力合作,利用低聚殼聚糖(oligoCS)的自組裝性能和生物黏附理化特性,在單個(gè)病毒顆粒表面進(jìn)行化學(xué)修飾以改變其黏膜附著能力。研究發(fā)現(xiàn),在合適反應(yīng)條件下,oligoCS分子可在納米尺度的單個(gè)病毒顆粒表面組裝形成一層功能性外殼(Ad@oligoCS),從而改變了病毒顆粒表面的電荷性,增強(qiáng)了病毒載體與黏膜組織表面的相互作用。研究還表明,oligoCS外殼在不影響病毒載體感染活性的基礎(chǔ)上,拓展了其對(duì)不同細(xì)胞種類的基因遞送效率。進(jìn)一步的RNA-seq分析和一系列功能實(shí)驗(yàn)發(fā)現(xiàn)并證實(shí)了該病毒載體疫苗復(fù)合物進(jìn)入細(xì)胞的方式從傳統(tǒng)的受體介導(dǎo)(receptor-dependent)轉(zhuǎn)變?yōu)閮?nèi)吞介導(dǎo)(phagocytosis-dependent),并高效激活了抗原遞呈細(xì)胞。因此,該策略有望成為一種有潛力的新型黏膜疫苗遞送系統(tǒng)。
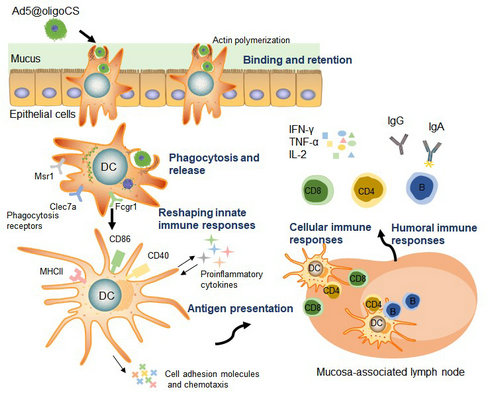
通過病毒載體疫苗界面修飾以研發(fā)新型高效黏膜疫苗的作用機(jī)理示意圖
基于上述研究發(fā)現(xiàn),研究人員在動(dòng)物模型中進(jìn)一步驗(yàn)證了該新策略作為研發(fā)黏膜疫苗的可行性。研究人員以攜帶熒光素酶(Luci)報(bào)告基因的重組病毒載體(Ad-luci)為模型,通過滴鼻方式研究了Ad-luci或Ad-luci@oligoCS在鼻腔黏膜表面的滯留時(shí)間和外源蛋白表達(dá)強(qiáng)度。結(jié)果表明,相比較于Ad-luci處理組,Luci蛋白在Ad-luci@oligoCS實(shí)驗(yàn)組小鼠鼻腔和肺臟中的表達(dá)時(shí)間和表達(dá)強(qiáng)度得以顯著提高,而這些外源蛋白在黏膜組織表面的持續(xù)刺激有利于高效誘發(fā)黏膜免疫應(yīng)答。接著,利用攜帶猴艾滋病(SIV)抗原的重組病毒載體疫苗(Ad-SIV)驗(yàn)證了該策略誘發(fā)黏膜免疫應(yīng)答的效果。相比較于Ad-SIV免疫組,在Ad-SIV@oligoCS實(shí)驗(yàn)組小鼠的鼻腔、肺臟、腸道、生殖道等黏膜組織都檢測(cè)到了更高水平的抗原特異性IgA抗體以及細(xì)胞免疫應(yīng)答。除黏膜免疫應(yīng)答外,該策略也在實(shí)驗(yàn)小鼠的外周血、脾臟等免疫組織中誘發(fā)了更高水平的IgG抗體以及多功能性T細(xì)胞等系統(tǒng)性免疫應(yīng)答。總之,這種病毒載體疫苗界面修飾技術(shù)可有效誘發(fā)出抗原特異的黏膜免疫應(yīng)答,對(duì)于研發(fā)新型高效黏膜疫苗有指導(dǎo)意義,該策略可被廣泛應(yīng)用于研發(fā)針對(duì)不同傳染病的新型黏膜疫苗。
該工作以“Shell-mediated phagocytosis to reshape viral-vectored vaccine-induced immunity”為題,于近日在線發(fā)表在生物材料類經(jīng)典期刊Biomaterials。論文第一作者為我校公共衛(wèi)生學(xué)院(深圳)馮鳳玲博士和浙江大學(xué)博士生郝海斌,通訊作者為我校公共衛(wèi)生學(xué)院(深圳)孫彩軍教授與浙江大學(xué)唐睿康教授、王曉雨副研究員以及中科院廣州生物院陳凌教授。該工作得到了國(guó)家重大科技專項(xiàng)、國(guó)家自然科學(xué)基金和深圳市科技計(jì)劃項(xiàng)目的資助。
論文鏈接:https://www.sciencedirect.com/science/article/pii/S014296122100418X